日本癌学会・日本対がん協会主催 第22回日本癌学会市民公開講座 講演2「患者さんひとりひとりの治療のために」
古川 洋一 先生(東京大学医科学研究所臨床ゲノム腫瘍学分野教授)
がんは遺伝情報の異常の蓄積
がんって、どんな病気でしょう?
われわれの体は、約60兆個の細胞でできています。これらの細胞は受精卵が分裂して分化・増殖したもので、全ての細胞に受精卵の遺伝情報がコピーされて含まれています。 この受精卵の遺伝情報は、両親からそれぞれ1セット(合計で2セット)受け継いだもので、これらの遺伝情報を「ゲノム」と呼んでいます。
がん細胞を調べると、正常な細胞とがん細胞で違う点がたくさんあります。 顕微鏡で調べると正常な細胞とがん細胞は形(形態)が違っています。 遺伝子が含まれている染色体を調べると染色体が壊れていたり、数に異常があったりします。 遺伝子の働きを調べると、正常で働いている遺伝子が働いていなかったり、逆に正常では働いていない遺伝子の働きが増えていたりします。 遺伝子の配列(遺伝暗号)を調べるとたくさんの異常が起こっています(図1)。
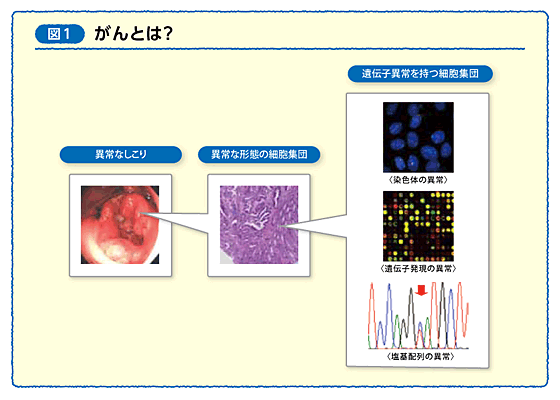
つまり、がんとは、本来は正常細胞と同じであるはずの、遺伝子や染色体を含むゲノムに異常が蓄積した病気ということができます。
ゲノムは遺伝子を含む遺伝情報を全て含んでいますが、その情報は4種類の塩基(DNA)が約30億個つながった配列でできています。 がん細胞には、平均すると数千から1万カ所以上の場所で塩基の異常が起こっています。 がんになるには、これら全ての異常が必要なのではなく、数個~十数個の重要な遺伝子異常が起こることが必要と考えられています。
また、異常は一度に起こるのではなく、正常細胞から前がん状態(がんになる前の段階)、そしてがん細胞へと変化する過程で、だんだん蓄積していくことが分かってきました。 例えば大腸がんの場合、正常な粘膜の中に小さな良性の腫瘍が(腺腫)ができるのに約6年、それが成長し、さらに悪性化してがんになるのにさらに約10年かかるといわれています。 がんが見つかった人は、実は十数年も前にがんの芽ができているのです。
分子標的薬の登場で劇的に変わった抗がん薬治療
「抗がん薬は怖い」と考えている人は多いのではないでしょうか? 昔から使われてきた抗がん薬の多くは、DNAの合成や細胞分裂を抑える働きを持っており、がん細胞だけでなく正常な細胞にも障害をもたらしていました。 これらの抗がん薬の治療を例えるなら、絨毯(じゅうたん)爆撃のようなものです(図2)。
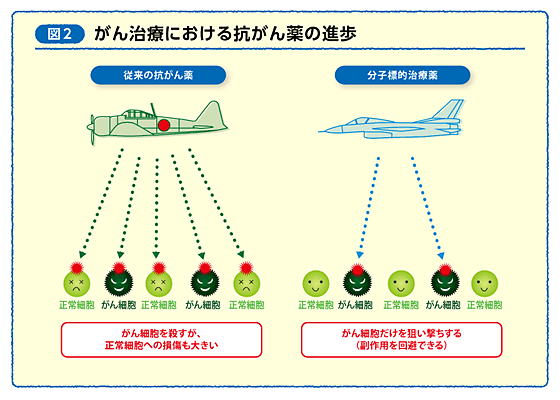
しかし近年は、がん細胞だけを攻撃する抗がん薬、分子標的薬ができてきました。 がん細胞をピンポイントで狙い撃ちする爆弾、ミサイルのようなものです。 高い効果が期待できるとともに、正常な細胞を攻撃しないため副作用が出にくいという特徴があります。
例えば、慢性骨髄性白血病の治療薬イマチニブ(商品名グリベック)が代表的な分子標的薬です。 この薬の登場で、慢性骨髄性白血病の治療は劇的に変わりました。
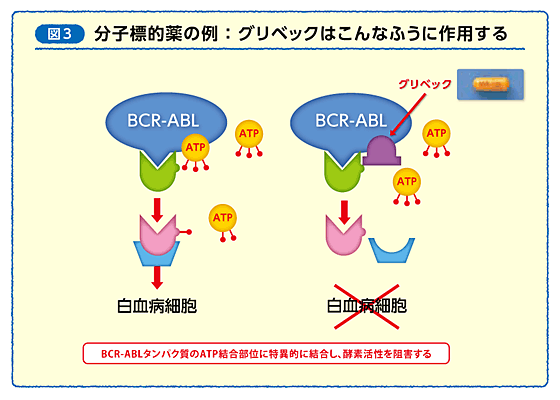
この病気の患者さんの染色体を調べると、ほとんどで特殊な染色体が見られます。 46個ある染色体のうち、22番染色体と9番染色体がちぎれてくっつき、異常な染色体を形づくっているのです。 22番染色体のBCR遺伝子と9番染色体のABL遺伝子の中でちぎれてくっついて「BCR-ABL」という異常な遺伝子ができます。 この異常な遺伝子がつくるタンパク質(BCR-ABLタンパク質)が細胞を死なないようにしたり、細胞の増殖を活性化したりすることで白血病を引き起こしているのです。
グリベックは、BCR-ABL遺伝子のエネルギー源となるATPという物質の入り口をブロックして、BCR-ABLタンパク質の活性を抑える薬です(図3)。 この薬によって、慢性骨髄性白血病の患者さんは助かるようになりました。
他にも、肺がんの治療薬として知られる「ゲフィチニブ(商品名イレッサ)」も分子標的薬です。 肺がんの一部には、EGFR遺伝子の異常によってがん化しているタイプがあります。 この遺伝子が変異してできるタンパク質の活性化部位にフタをし、その結果としてがん細胞の生存に必要なスイッチをオフにする薬がイレッサです。
イレッサは世界に先駆けて日本で初めて市販され、副作用で亡くなった人がいたため大きなニュースになりましたが、この薬で助かった患者さんもたくさんいます。
肺がんにはEGFR遺伝子以外にも、いくつかのがん化の原因となる遺伝子異常が報告されていて、それぞれの異常に対応する新しい分子標的薬が開発されつつあります。 まだ全ての遺伝子異常に対応した薬があるわけではありませんが、がんのゲノムを調べ、その患者さんに効く治療薬を選ぶ時代がやってきているのです。
ゲノムを調べて薬の種類や量を決定
がんのゲノム研究は、抗がん薬の使い方にも新しいアプローチをもたらしています。
好例は、白血病の研究者でありながら自身も白血病を発症した、米国のルーカス・ワットマン博士です。 彼は白血病の治療を受けましたが、これまでの白血病治療薬が効きませんでした。 そこで自分の白血病のゲノムを解析した結果、自分の病気には腎臓がんの薬「スニチニブ(商品名スーテント)」が標的とする異常があることを突き止めたのです。 実際にスーテントを投与したところ、効果がありました。
このように、今後は腫瘍のできた臓器別に抗がん薬を選ぶのではなく、ゲノムの異常別に抗がん薬を選ぶように使い方が変わって行くでしょう。
薬の投与量にもゲノムの研究成果が生かされるようになりつつあります。
乳がんの手術後に使われる治療薬「タモキシフェン(商品名ノルバデックスなど)」は、肝臓のCYP2D6という酵素で代謝されてエンドキシフェンという物質になり、女性ホルモン(エストロゲン)の働きを抑えて乳がんを小さくします。
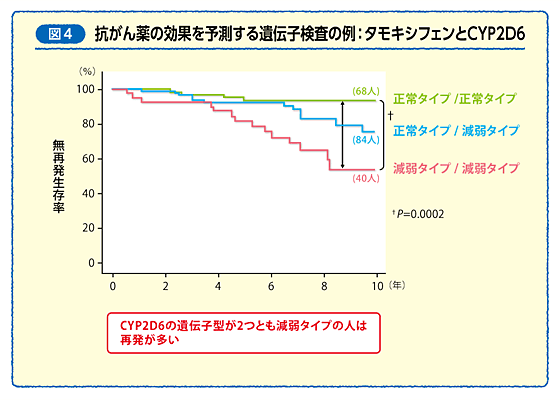
このCYP2D6は人によって遺伝子配列が異なる部分があり、その結果としてタモキシフェンの効果に違いが出ることが分かってきました。 日本人の約5人に1人が持っているという酵素の働きが弱い遺伝子配列(CYP2D6*10=スターテン)を父母の両方から受け継いだ人は、同じ量のタモキシフェンを投与しても血液中のエンドキフェン濃度が低く、再発しやすいことが分かりました(図4)。 つまり、CYP2D6スターテンを持つ人は、タモキシフェンが効きにくいということです。 こうした配列の患者さんに対し、タモキシフェンの量を増やして投与した効果を調べる臨床研究が行われています。
副作用もゲノムで予測、患者さんに優しい治療に
副作用についても、ゲノムは新しい時代をもたらしています。
「イリノテカン(商品名カンプトなど)」は、肺がんや大腸がん、卵巣がんなど幅広いがんに使われる抗がん薬ですが、2割ほどの人では骨髄の働きが低下して白血球や血小板の数が少なくなったり、下痢、吐き気がとても強く出たりすることが知られています。 実は、この薬はUGT1A1という酵素で分解されて無毒化されるのですが、この酵素をつくるUGT1A1遺伝子の配列のタイプによって副作用の出やすさが異なることが分かりました。 そこで、この遺伝子配列を投与前に調べて薬の量を調節することができるようになりました。
他にも、小児白血病で使われる「メルカプトプリン(商品名ロイケリン)」も副作用が出やすい遺伝子の配列が分かっています。 この配列を持つ人は300人に1人程度とまれですが、骨髄抑制や肝機能障害などの重い副作用を避けるため、遺伝子配列を調べてから投与することが推奨されています。
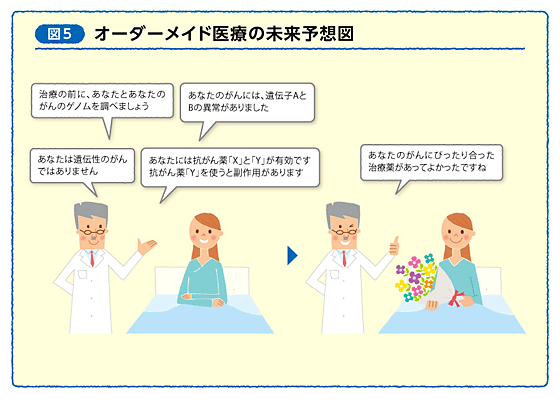
患者さんのがんのゲノムを調べて、そのがんに合った薬を選び、薬の効果や副作用などの体質に関わるゲノムを調べて投与量を決める、このような一人一人に合った治療 “オーダーメイド医療”が、今後さらに加速する見通しです。 2~3年後には、がんの治療を始める前に、まず患者さんと患者さんのがんのゲノムを調べるようになるものと期待されます(図5)。 それによって、患者さんに優しい治療が実現するはずです。
(企画・制作:あなたの健康百科)






